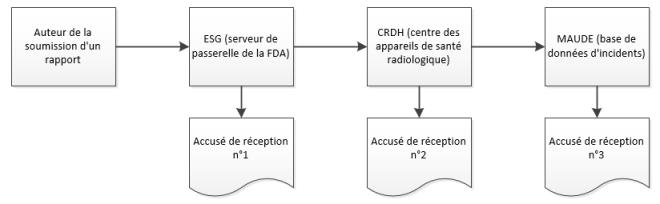
Vue d'ensemble du processus eMDR
Le projet de rapports sur les appareils médicaux électroniques (eMDR, Electronic Medical Device Reporting) doit sa création à l'office de contrôle des médicaments et des produits alimentaires aux Etats-Unis (FDA, Food and Drug Administration). Ce projet permet aux fabricants, aux importateurs et aux configurations personnalisées d'envoyer les rapports d'incidents de leurs appareils médicaux par voie électronique.
Les eMDR sont transmis via le portail de soumission électronique (ESG, Electronic Submissions Gateway), une solution à l'échelle de l'entreprise permettant la validation des soumissions réglementaires transmises par voie électronique. Le portail ESG permet l'envoi sécurisé des informations réglementaires, à des fins de révisions, via un point d'entrée unique.
|
|
Pour configurer les eMDR sur votre site Windchill Risk and Reliability, consultez le manuel Mise en route des eMDR. |
Options de soumission électronique
FDA prend en charge deux options de soumission électronique :
• Rapport par lot pour les volumes élevés
◦ Soumission d'un formulaire de rapport de sécurité individuel (ICSR, Individual Case Safety Report) correspondant au niveau 7 sur l'échelle de santé (HL7, Health Level 7)
◦ Recours au B2B afin de soumettre des fichiers XML via le portail de la FDA
• Rapport unique pour les volumes peu élevés
◦ Soumission d'un formulaire 3500Z
◦ Recours à WebTrader afin de soumettre des fichiers ZIP via le portail ESG
Processus des eMDR
Windchill Risk and Reliability a créé une version en ligne du formulaire ICSR HL7 pour les volumes élevés. Dès que vous avez rempli et soumis le formulaire, Windchill Customer Experience Management convertit les entrées au format XML dans le formulaire 3500A destiné à la FDA. Windchill Customer Experience Management transmet ensuite le formulaire à la FDA.
Au cours du processus de soumission, Windchill Customer Experience Management reçoit 3 accusés de réception de l'ESG, relatifs au statut d'un eMDR. Windchill Customer Experience Management traite automatiquement les accusés de réception entrants et affiche les données de chacun dans le tableau des soumissions pour chaque eMDR. Si la soumission est mise en échec durant la transmission de l'un de ces 3 accusés, apportez les corrections appropriées, puis effectuez une nouvelle soumission.
◦ La livraison et le temps d'exécution de votre soumission dépendent de sa taille totale. Plus la soumission est volumineuse, plus elle sera longue à livrer et à exécuter.
◦ Vous devez disposer d'une signature électronique pour effectuer des soumissions.
◦ Les noms de fichier des soumissions ne peuvent comprendre qu'un seul point, utilisé pour indiquer l'extension du type de fichier (par exemple, 555.xml ou 555.pdf).
2. Lorsque la soumission est chargée sur le portail ESG, vous recevez un premier accusé de réception juste après la soumission de l'eMDR, à moins que le portail ESG soit inactif pour des raisons de maintenance.
◦ Si vous avez d'autres questions, contactez ESG à l'adresse
esgreg@gnsi.com.
3. L'eMDR est automatiquement redirigé de l'ESG vers le centre des appareils de santé radiologique (CDRH, Center for Devices and Radiological Health). Lorsque la soumission est chargée sur le portail CDRH, vous recevez un deuxième accusé de réception.
| Le système FDA peut mettre jusqu'à 48 heures pour transmettre le deuxième accusé de réception. Si vous ne recevez aucune réponse au cours de cette période, contactez ESG par courrier électronique à l'adresse esgreg@gnsi.com en précisant le numéro du rapport. N'effectuez pas une nouvelle soumission d'eMDR afin que la mise en échec de la soumission ne soit affichée dans Windchill Customer Experience Management ou avant d'avoir obtenu l'aval de la FDA. Pour connaître la procédure, consultez la section Résolution d'un eMDR retardé. |
4. Lorsque le CDRH valide et charge la soumission dans la base de données d'incidents (MAUDE), vous recevez un troisième accusé de réception. L'ensemble des erreurs survenant durant la validation et le chargement sont indiquées.
| Si le troisième accusé de réception contient des messages d'erreur, vous devez corriger ces erreurs et procéder à une nouvelle soumission, en revenant à la première étape. Après la nouvelle soumission, vous recevez un autre ensemble de trois accusés de réception. Le système FDA peut mettre jusqu'à 48 heures pour transmettre le deuxième ou le troisième accusé de réception. Si vous ne recevez aucune réponse au cours de cette période, contactez la FDA par courrier électronique à l'adresse emdr@fda.hhs.gov en précisant le numéro du rapport. Si vous contactez ESG, patientez 24 heures avant de contacter la FDA. Ne resoumettez pas l'eMDR tant que la soumission n'a pas échoué, sauf sur invitation de la FDA. Pour connaître la procédure, consultez la section Résolution d'un eMDR retardé. |