eMDR 进程概述
食品和药物管理局 (FDA) 已经启动“电子医疗器械报告”(eMDR) 项目。此项目允许制造商、进口商和用户机构以电子形式提交医疗器械不良事件报告。
eMDR 通过“电子提交网关”(ESG) (即一种在机构范围中用于接受电子管理提交的解决方案) 进行提交。ESG 能够确保从单一进入点安全提交待审阅的管理信息。
|
|
要在 Windchill Risk and Reliability 安装上设置 eMDR,请参阅 eMDR 入门。
|
电子提交选项
FDA 支持两种电子提交选项:
• 大量批处理报告
◦ 提交一份健康信息交换第七层协议 (Health Level 7, HL7) 个案安全性报告 (Individual Case Safety Report, ICSR) 表单
◦ 使用 B2B 通过 FDA 网关提交 XML 文件
• 少量单一报告
◦ 提交 3500Z 表单
◦ 使用 WebTrader 通过 ESG 提交 ZIP 文件
eMDR 工作流
Windchill Risk and Reliability 已创建了大量健康信息交换第七层协议 (Health Level 7, HL7) 个案安全性报告 (Individual Case Safety Report, ICSR) 表单的在线版本。完成并提交表单后,Windchill Customer Experience Management 会使用标准 XML 将输入内容转译为 FDA 3500A 格式。随后,Windchill Customer Experience Management 会将该表单转发至 FDA。
在提交过程中,Windchill Customer Experience Management 会收到 ESG 发来的关于 eMDR 状况的三个单独确认。Windchill Customer Experience Management 自动处理传入的确认,并在每个 eMDR 的提交表中显示每个确认的数据。如果在这三次确认中的任何一次确认期间发生提交失败,则必须进行更正并重新提交。
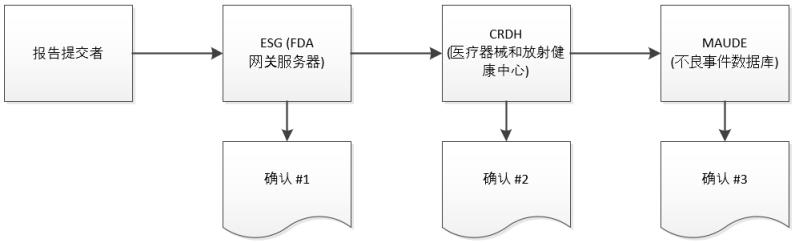
1. 提交 eMDR。有关说明,请参阅创建或更新 eMDR。
◦ 交付和处理时间取决于提交文件的总体大小;提交的文件越大,所需的交付和处理时间越长。
◦ 您必须具有电子签名方可执行提交。
◦ 提交文件名中只能包含一个句点,用于指示文件类型扩展名 (例如 555.xml 或 555.pdf)。
2. 除非 ESG 因维护而关闭,否则如果提交到达 ESG,您应在提交 eMDR 后很快接收到第 1 条确认消息。
◦ 请检查 ESG 网站状况,网址为:http://www.fda.gov/Food/GuidanceRegulation/FoodFacilityRegistration/ucm161883.htm。
◦ 如有任何其他疑问,请与 ESG 联系,邮件地址为 esgreg@gnsi.com。
3. eMDR 自动从 ESG 路由至医疗器械和放射健康中心 (Center for Devices and Radiological Health, CDRH)。如果提交到达 CDRH,应当会收到第 2 条确认消息。
FDA 系统可能需要 48 小时才能发送第二条确认消息。如果您未在此时间范围内收到响应,请附上此报告的编号与 ESG 取得联系,邮件地址为 esgreg@gnsi.com。只有 Windchill Customer Experience Management 中显示提交失败或 FDA 指示您重新提交 eMDR 时,您才能执行该操作。有关说明,请参阅解决延迟的 eMDR。 |
4. 当 CDRH 对提交进行验证并将其加载至不良事件数据库 (MAUDE) 中时,应该会收到第 3 条确认消息。验证和加载期间出现的任何错误均会被记录。
如果在第三条确认消息中存在错误消息,必须从步骤 1 开始对错误进行更正并重新提交。重新提交后,将会收到另一组三条确认消息。 FDA 系统可能需要 48 小时才能发送第 2 条或第 3 条确认消息。如果在此时间范围内未收到响应,请向 FDA 发送电子邮件并附上此报告的编号,邮件地址为 emdr@fda.hhs.gov。联系 ESG 后,需要等待 24 小时才能联系 FDA,反之亦然。请务必于提交失败或收到 FDA 指示后再重新提交 eMDR。有关说明,请参阅解决延迟的 eMDR。 |