eMDR-Prozessübersicht
Die Food and Drug Administration (FDA) hat das eMDR-Projekt (Electronic Medical Device Reporting) ins Leben gerufen. Dieses Projekt erlaubt Herstellern, Importeuren und Benutzern, ihre Zwischenfallberichte für medizinische Geräte elektronisch zu senden.
Die eMDRs werden über das elektronische Einreichungs-Gateway (ESG) gesendet, eine behördenweite Lösung zur Annahme regulatorischer Informationen in elektronischer Form. Das ESG ermöglicht die sichere Übermittlung regulatorischer Informationen zur Prüfung über einen zentralen Zugangspunkt.
|
|
Informationen dazu, wie Sie eMDRs in der Windchill Risk and Reliability Installation einrichten, finden Sie unter Erste Schritte mit eMDRs. |
Optionen für die elektronische Einreichung
Die FDA unterstützt zwei Optionen für elektronische Einreichungen:
• Umfangreiche Batch-Berichterstellung
◦ Einreichen eines ICSR-Formulars (Individual Case Safety Report) mit HL7 (Health Level 7)
◦ Senden von XML-Dateien über das FDA-Gateway mithilfe von B2B
• Einzelne Berichterstellung mit geringem Volumen
◦ Senden eines 3500Z-Formulars
◦ ZIP-Dateien über das ESG mithilfe von WebTrader senden
eMDR-Workflow
Windchill Risk and Reliability hat eine Onlineversion des ICSR-Formulars (Individual Case Safety Report) mit HL7 (Health Level 7) für hohe Volumen erstellt. Nachdem Sie das Formular ausgefüllt und gesendet haben, übersetzt Windchill Customer Experience Management die Eingabe in das 3500A-Format mithilfe von Standard-XML für die FDA. Windchill Customer Experience Management leitet das Formular dann an die FDA weiter.
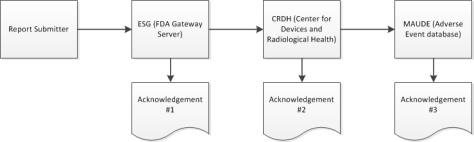
Während der Einreichung erhält Windchill Customer Experience Management drei separate Bestätigungen vom ESG zum eMDR-Status. Windchill Customer Experience Management verarbeitet automatisch eingehende Bestätigungen und zeigt die Daten jeder einzelnen Bestätigung in der Einreichungstabelle für jedes eMDR an. Wenn die Einreichung während einer der drei Bestätigungen fehlschlägt, müssen Sie Korrekturen vornehmen und erneut einreichen.
◦ Sende- und Verarbeitungszeiten hängen von der gesamten Größe der Übertragung ab; das Senden und Verarbeiten größerer Einreichungen dauert länger.
◦ Sie benötigen eine elektronische Signatur, um Einreichungen vorzunehmen.
◦ Einreichungsdateinamen können nur einen Punkt enthalten, mit dem die Dateityperweiterung angegeben wird (z.B. 555.xml oder 555.pdf).
2. Wenn die Einreichung das ESG erreicht, sollten Sie kurz nachdem Sie das eMDR gesendet haben, die erste Bestätigung erhalten, es sei denn, das ESG ist aufgrund von Wartungsarbeiten nicht verfügbar.
◦ Wenn Sie weitere Fragen haben, wenden Sie sich an das ESG unter
esgreg@gnsi.com.
3. Das eMDR wird automatisch vom ESG zum CDRH (Center for Devices and Radiological Health) weitergeleitet. Wenn Ihre Einreichung das CDRH erreicht, sollten Sie die zweite Bestätigung erhalten.
| Es kann bis zu 48 Stunden dauern, bis das FDA-System die zweite Bestätigung sendet. Wenn Sie zu diesem Zeitpunkt keine Antwort erhalten haben, wenden Sie sich unter Angabe der Berichtsnummer an das ESG unter esgreg@gnsi.com. Reichen Sie das eMDR erst neu ein, wenn die Einreichung in Windchill Customer Experience Management fehlschlägt, oder die FDA Sie anweist, dies zu tun. Anweisungen finden Sie unter Ein verzögertes eMDR auflösen. |
4. Wenn das CDRH die Einreichung prüft und in die MAUDE-Datenbank (Adverse Event) lädt, sollten Sie dritte Bestätigung erhalten. Alle Fehler, die während des Validierungs- und Ladevorgangs auftreten, werden vermerkt.
| Wenn die dritte Bestätigung Fehlermeldungen enthält, müssen Sie die Fehler beheben und das Formular erneut einreichen (beginnend mit Schritt 1). Nachdem Sie das Formular erneut gereicht haben, erhalten Sie weitere drei Bestätigungen. Es kann bis zu 48 Stunden dauern, bis das FDA-System die zweite und dritte Bestätigung sendet. Wenn Sie zu diesem Zeitpunkt keine Antwort erhalten, senden Sie unter Angabe der Berichtsnummer eine E-Mail an die FDA unter emdr@fda.hhs.gov. Warten Sie, nachdem Sie mit dem ESG Kontakt aufgenommen haben, 24 Stunden, bis Sie mit der FDA Kontakt aufnehmen. Reichen Sie das eMDR erst neu ein, wenn die Einreichung fehlschlägt, oder die FDA Sie dazu anweist. Anweisungen finden Sie unter Ein verzögertes eMDR auflösen. |