eMDR 流程概觀
美國食品暨藥物管理局 (FDA) 已啟動「電子醫療裝置報告」(eMDR) 專案。此專案可讓製造商、進口商與使用者設備提交其電子版醫療裝置不利事件報告。
eMDRs 透過「電子提交閘道」(ESG) 提交,這是接受電子管理提交的全機構解決方案。ESG 可使用單一輸入點安全提交管理資訊以供審核。
|
|
欲為 Windchill Risk and Reliability 安裝設定 eMDR,請參閱eMDR 入門。
|
電子提交的選項
FDA 支援兩個電子提交選項:
• 大量批次報告
◦ 提交健康層級 7 (HL7) 個別案例安全報告 (ICSR) 表單
◦ 使用 B2B 來透給 FDA 閘道提交 XML 檔案
• 小量單一報告
◦ 提交 3500Z 表單
◦ 使用 WebTrader 透過 ESG 提交 ZIP 檔案
eMDR 工作流程
Windchill Risk and Reliability 已建立大量健康層級 7 (HL7) 個別案例安全報告 (ICSR) 表單的線上版本。在您填妥並提交表單之後,Windchill Customer Experience Management 會為使用標準 XML 的 FDA 將輸入轉換為 3500A 格式。然後,Windchill Customer Experience Management 會將表單轉送至 FDA。
在提交過程中,Windchill Customer Experience Management 會收到來自 ESG 之有關 eMDR 狀況的三種不同確認。Windchill Customer Experience Management 會自動處理引入確認,並在每個 eMDR 的提交表格中顯示每個確認的資料。如果提交在其中任何一種確認期間失敗,您必須進行修正並重新提交。
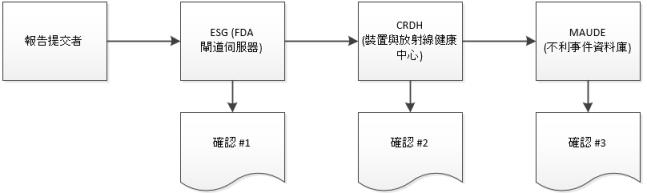
1. 提交您的 eMDR。如需指示,請參閱建立或更新 eMDR。
◦ 遞送與處理時間取決於提交的整體大小;提交越大,遞送與處理的時間就越長。
◦ 您必須擁有電子簽名才能進行提交。
◦ 提交檔案名稱只能包含一個句點,用來指示檔案類型副檔名 (例如 555.xml 或 555.pdf)。
2. 當您的提交到達 ESG 時,您應會在您提交 eMDR 之後快速收到確認 #1,除非 ESG 正在停機進行維護。
◦ 請到 ESG 網站檢查狀況,網址為:http://www.fda.gov/Food/GuidanceRegulation/FoodFacilityRegistration/ucm161883.htm。
◦ 如果您還有問題,請與 ESG 聯絡,地址為 esgreg@gnsi.com。
3. eMDR 會自動從 ESG 傳送至「裝置與放射線健康中心」(CDRH)。當您的提交到達 CDRH 時,您應會收到確認 #2。
FDA 系統在傳送第二份確認之前可能需時 48 小時。如果您在該時間之內沒有收到回應,請與 ESG 聯絡,地址為 esgreg@gnsi.com,並附帶報告編號。提交在 Windchill Customer Experience Management 中顯示為失敗之前,或 FDA 指示您重新提交 eMDR 之前,請勿重新提交 eMDR。如需指示,請參閱解決延遲的 eMDR。 |
4. 當 CDRH 驗證提交並將提交載入至「不利事件」資料庫 (MAUDE) 時,您應會收到確認 #3。在驗證與載入期間發生的任何錯誤都會記錄下來。
如果第三份確認中有任何錯誤訊息,您必須修正錯誤並重新提交,從步驟 1 開始。重新提交之後,您將會收到另一組第三份確認。 FDA 系統在傳送確認 #2 或 #3 之前可能需時 48 小時。如果您在該時間內未收到回應,請傳送電子郵件給 FDA,地址為 emdr@fda.hhs.gov,並附上報告編號。在聯絡 ESG 及聯絡 FDA 之前,請先等候 24 小時。若非提交失敗,或 FDA 有所指示,否則請勿重新提交 eMDR。如需指示,請參閱解決延遲的 eMDR。 |