Resumen del proceso de eMDR
La FDA (Food and Drug Administration) ha iniciado el proyecto eMDR (Electronic Medical Device Reporting). Este proyecto permite a los fabricantes, los importadores y las instalaciones del usuario enviar de forma electrónica sus informes de evento adverso del dispositivo médico.
Los eMDR se envían a través del Electronic Submissions Gateway (ESG), una solución dirigida a todos los miembros de la agencia para aceptar envíos reguladores electrónicos. El ESG permite el envío seguro de información reguladora para su revisión mediante un único punto de entrada.
|
|
Para configurar la instalación de los eMDR en Windchill Risk and Reliability, consulte Introducción a los eMDR.
|
Opciones para el envío electrónico
La FDA soporta dos opciones para el envío electrónico:
• Creación de informes por lotes de gran volumen
◦ Envío de un formulario Informe de seguridad de casos individuales (ICSR) del Nivel de integridad 7 (HL7)
◦ Uso de procesos B2B para enviar ficheros XML a través del portal de la FDA
• Creación de informes únicos de poco volumen
◦ Envío de un formulario 3500Z
◦ Utilización de WebTrader para enviar ficheros ZIP a través del ESG
Proceso de trabajo de eMDR
Windchill Risk and Reliability ha creado una versión en línea del formulario Informe de seguridad de casos individuales (ICSR) del Nivel de integridad 7 (HL7). Después de completar y enviar el formulario, Windchill Customer Experience Management convierte la entrada en el formato 3500A para la FDA utilizando XML estándar. A continuación, Windchill Customer Experience Management envía el formulario a la FDA.
Durante el proceso de envío, Windchill Customer Experience Management recibe tres confirmaciones separadas de ESG sobre el estatus de un eMDR. Windchill Customer Experience Management procesa automáticamente acuses de recibo entrantes y muestra los datos de cada acuse de recibo en la tabla de envío para cada eMDR. Si el envío falla durante cualquiera de las confirmaciones, se deben realizar las correcciones necesarias y volver al eMDR.
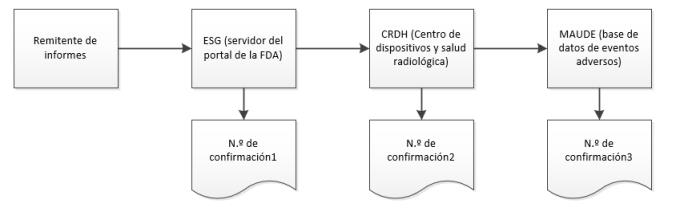
1. Envío del eMDR. Para obtener las instrucciones, consulte Creación o actualización de un eMDR.
◦ El envío y el tiempo de procesamiento depende del tamaño total del envío; los envíos más grandes pueden tardar más en ser entregados y procesados.
◦ El usuario debe disponer de una firma electrónica para realizar envíos.
◦ Los nombres de fichero del envío pueden incluir solamente un punto, que se utiliza para indicar la extensión de tipo de fichero (por ejemplo, 555.xml o 555.pdf).
2. Cuando el envío alcance el ESG, se debería recibir el reconocimiento n.º 1 justo después de enviar el eMDR, a menos que el ESG esté fuera de servicio por motivos de mantenimiento.
◦ Compruebe el estatus en el sitio Web de ESG en http://www.fda.gov/Food/GuidanceRegulation/FoodFacilityRegistration/ucm161883.htm.
◦ Si tiene más preguntas, póngase en contacto con el ESG en esgreg@gnsi.com.
3. El eMDR se distribuye automáticamente desde el ESG al CDRH (Center for Devices and Radiological Health). Cuando el envío llega al CDRH, se debería recibir el acuse de recibo n.º 2.
El sistema de la FDA puede tardar hasta 48 horas antes de enviar el segundo acuse de recibo. Si no se recibe una respuesta en dicho tiempo, póngase en contacto con el ESG en esgreg@gnsi.com con el número de informe. No reenvíe el eMDR hasta que el envío se muestre como fallido en Windchill Customer Experience Management o hasta que la FDA indique que se debe reenviar. Para obtener las instrucciones, consulte Resolución de un eMDR demorado. |
4. Cuando el CDRH valida y carga el envío en Adverse Event database (MAUDE), debería recibirse el acuse de recibo n.º 3. Se indican todos los errores que se produzcan durante la validación y la carga.
Si hay mensajes de error en el tercer acuse de recibo, se deben corregir los errores y hacer un reenvío, empezando por el paso 1. Al realizar el reenvío, se recibirá otro conjunto de tres acuses de recibo. El sistema de la FDA puede tardar hasta 48 horas antes de enviar el acuse de recibo n.º 2 o n.º 3. Si no se recibe una respuesta durante este periodo de tiempo, envíe un correo electrónico a la FDA a emdr@fda.hhs.gov con el número del informe. Espere 24 horas después de ponerse en contacto con el ESG y antes de ponerse en contacto con el FDA. No reenvíe el eMDR hasta que falle el envío o la FDA le indique que lo haga. Para obtener las instrucciones, consulte Resolución de un eMDR demorado. |