Общие сведения о процессе eMDR
Проект электронной отчетности по медицинским устройствам (Electronic Medical Device Reporting, eMDR) запущен Управлением США по контролю качества пищевых продуктов и лекарственных средств (Food and Drug Administration, FDA). Этот проект позволяет изготовителям, импортерам и организациям пользователей добровольно отправлять в электронном виде отчеты о возникших осложнениях, связанных с медицинским оборудованием.
Отчеты eMDR отправляются через портал Electronic Submissions Gateway (ESG), представляющий собой решение в масштабах управления FDA для приема электронных документов, направляемых в контролирующий орган. ESG обеспечивает безопасную передачу направляемой на проверку информации с использованием единой точки входа.
Варианты электронной подачи документов
FDA поддерживает две возможности для электронного представления документов.
• Отправка отчетов пакетами большого объема
◦ Отправка индивидуальной формы отчета о безопасности Health Level 7 (HL7) Individual Case Safety Report (ICSR)
◦ Использование модели "бизнес для бизнеса" для отправки XML-файлов через интерфейс FDA
• Отправка одного отчета небольшого объема
◦ Отправка формы 3500Z
◦ Использование системы WebTrader для отправки ZIP-файлов через портал ESG
Рабочий процесс eMDR
В Windchill Risk and Reliability создана интерактивная версия формы Health Level Seven (HL7) Individual Case Safety Report (ICSR). После заполнения и отправки формы Windchill Customer Experience Management преобразует входные данные в формат 3500A для FDA, используя стандартный XML. Затем Windchill Customer Experience Management пересылает форму в FDA.
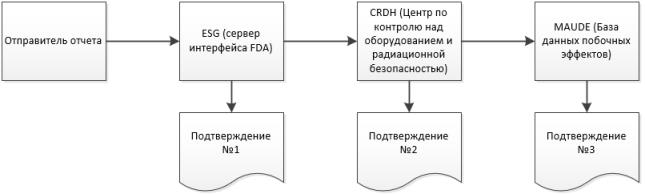
Во время процесса отправки Windchill Customer Experience Management получает три отдельных подтверждения от ESG о статусе eMDR. Windchill Customer Experience Management автоматически обрабатывает входящие подтверждения и показывает данные каждого подтверждения в таблице отправки для каждого eMDR. Если не удалось выполнить отправку для получения какого-либо из этих трех подтверждений, необходимо внести исправления и повторить отправку.
◦ Время доставки и обработки зависит от общего размера отправляемой отчетности - доставка и обработка отчетов большого объема занимает больше времени.
◦ Для отправки отчетности вам необходима цифровая подпись.
◦ Имена отправляемых файлов могут содержать только одну точку, указывающую расширение типа файла (например, 555.xml или 555.pdf).
2. По достижении отправляемыми отчетами портала ESG вы должны получить подтверждение № 1 через короткое время после отправки eMDR, если портал ESG не закрыт на техническое обслуживание.
3. eMDR автоматически направляется с портала ESG в Центр по контролю оборудования и радиационной безопасности (Center for Devices and Radiological Health, CDRH). Когда отправляемые отчеты попадают в CDRH, вы должны получить подтверждение № 2.
| Системе FDA может потребоваться до 48 часов, чтобы отправить второе подтверждение. Если за это время вы не получили ответ, обратитесь в ESG по адресу esgreg@gnsi.com, указав номер отчета. Не следует выполнять повторную отправку eMDR, пока представление не отобразится как завершившееся неудачно в Windchill Customer Experience Management или пока из FDA не будет получено указание сделать это. Инструкции см. в разделе Отправка задержанных отчетов eMDR. |
4. После того как CDRH проверит отправляемые отчеты и загрузит их в базу данных о возникших осложнениях, связанных с медицинским оборудованием (MAUDE), вы должны получить подтверждение № 3. Обо всех ошибках, возникающих во время проверки и загрузки, сообщается в уведомлении.
| Если в третьем подтверждении имеются сообщения об ошибках, необходимо исправить ошибки и снова отправить отчетность, начиная с шага 1. После повторной отправки вы получите еще один комплект из трех подтверждений. Системе FDA может потребоваться до 48 часов, чтобы отправить подтверждение № 2 или № 3. Если за это время вы не получили ответ, отправьте электронное письмо в FDA по адресу emdr@fda.hhs.gov, указав номер отчета. После обращения в ESG подождите 24 часа, прежде чем обращаться в FDA. Не отправляйте повторно eMDR, пока не получите сообщение о сбое при передаче или инструкцию от FDA. Инструкции см. в разделе Отправка задержанных отчетов eMDR. |