eMDR プロセスの概要
米国食品医薬品局 (FDA) は、Electronic Medical Device Reporting (eMDR) プロジェクトを開始しました。このプロジェクトでは、製造メーカー、インポート担当者、ユーザー設備が、医療機器の有害イベントレポートを電子申請できます。
eMDR は Electronic Submissions Gateway (ESG) を通じて送信されます。ESG は、規制の電子申請を受け入れるための部局規模のソリューションです。ESG により、レビュー用の規制情報を 1 つの窓口で安全に送信できます。
|
|
Windchill Risk and Reliability インストールに eMDR を設定するには、 eMDR を使用する前にを参照してください。
|
電子申請のオプション
FDA は電子申請のために 2 つのオプションをサポートしています。
• 大量のバッチレポート
◦ Health Level 7 (HL7) Individual Case Safety Report (ICSR) フォームの送信
◦ B2B を使用して FDA ゲートウェイ経由で XML ファイルを送信
• 少量の単一レポート
◦ 3500Z フォームの送信
◦ WebTrader を使用して ESG 経由で .ZIP ファイルを送信
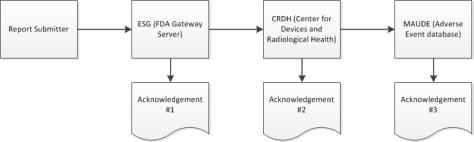
eMDR ワークフロー
Windchill Risk and Reliability は、大容量の Health Level Seven (HL7) Individual Case Safety Report (ICSR) フォームのオンラインバージョンを作成しました。フォームを入力して送信すると、Windchill Customer Experience Management で標準の XML を使用する FDA 用の 3500A フォーマットに入力が変換されます。その後、Windchill Customer Experience Management でそのフォームが FDA に送信されます。
申請プロセス中、Windchill Customer Experience Management は eMDR のステータスに関する 3 つの確認を ESG から受信します。Windchill Customer Experience Management では受信確認が自動的に処理され、各 eMDR のサブミットテーブルに各確認のデータが表示されます。その 3 つの確認のいずれかで申請が失敗した場合、修正して再サブミットする必要があります。
◦ 配信時間と処理時間はサブミットの全体サイズによって異なります。大規模なサブミットでは配信と処理に長い時間がかかります。
◦ サブミットを行うには、電子署名が必要です。
◦ サブミットのファイル名に含むことができるピリオドは 1 つだけで、これはファイルタイプの拡張子を示すために使用します (555.xml または 555.pdf など)。
2. サブミットが ESG に到達すると、ESG がメンテナンスのためにダウンしていないかぎり、eMDR の送信後すぐに 1 番目の確認を受信します。
3. eMDR は、ESG から Center for Devices and Radiological Health (CDRH) に自動的にルーティングされます。サブミットが CDRH に到達すると、2 番目の確認を受信します。
| FDA システムが 2 番目の確認を送信するまでには、最大で 48 時間かかる可能性があります。その時間内に応答を受信しなかった場合は、レポート番号を使用して ESG ( esgreg@gnsi.com) に問い合わせてください。 Windchill Customer Experience Management で申請が失敗したことを示されるか FDA によって指示されるまでは、eMDR を再サブミットしないでください。手順の詳細については、 遅延した eMDR の解決を参照してください。 |
4. CDRH が検証を行い、サブミットを Adverse Event database (MAUDE) に読み込むと、3 番目の確認を受信します。検証および読み込み中に発生したエラーが記載されています。
| 3 番目の確認にエラーメッセージがある場合、エラーを修正して再サブミットし、ステップ 1 からやり直す必要があります。再サブミット後、3 つの確認のセットを新たに受信します。 FDA システムが 2 番目または 3 番目の確認を送信するまでには、最大で 48 時間かかる可能性があります。その時間内に応答を受信しなかった場合は、レポート番号を記載した電子メールを FDA ( emdr@fda.hhs.gov) に送信してください。ESG への問い合わせから FDA への問い合わせまでは、24 時間待ってください。サブミットが失敗するか FDA から指示されるまで、eMDR を再サブミットしないでください。手順の詳細については、 遅延した eMDR の解決を参照してください。 |