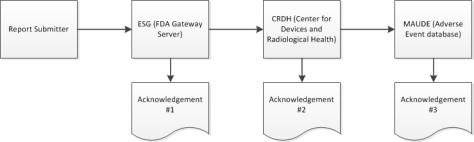
Panoramica del processo eMDR
La Food and Drug Administration (FDA) ha avviato il progetto Electronic Medical Device Reporting (eMDR). Tale progetto consente ai produttori, agli importatori e alle strutture dell'utente di inviare i report dell'evento negativo del dispositivo medico in formato elettronico.
Gli eMDR vengono inviati tramite l'Electronic Submissions Gateway (ESG), una soluzione a livello di agenzia che consente di accettare gli invii normativi elettronici. L'ESG consente di inviare in modo sicuro le informazioni normative per l'esame utilizzando un unico punto di immissione.
Opzioni per l'invio elettronico
La FDA supporta due opzioni per l'invio elettronico:
• generazione di report in batch in grandi quantità
◦ invio di un modulo Health Level 7 (HL7) Individual Case Safety Report (ICSR)
◦ utilizzo di B2B per inviare file XML tramite FDA Gateway
• generazione di report singoli in piccole quantità
◦ invio di un modulo 3500Z
◦ utilizzo di WebTrader per inviare file ZIP tramite ESG
Workflow eMDR
Windchill Quality Solutions ha creato una versione in linea del modulo in grandi quantità Health Level Seven (HL7) Individual Case Safety Report (ICSR). Una volta completato e inviato il modulo, Windchill Customer Experience Management converte l'input nel formato 3500A per la FDA utilizzando il formato XML standard. Windchill Customer Experience Management inoltra quindi il modulo alla FDA.
Durante il processo di invio, Windchill Customer Experience Management riceve tre riconoscimenti distinti dall'ESG sullo stato di un eMDR. Windchill Customer Experience Management elabora automaticamente i riconoscimenti in ingresso e mostra i dati di ciascun riconoscimento nella tabella di invio di ogni eMDR. Se l'invio ha esito negativo durante i uno dei tre riconoscimenti, è necessario apportare le correzioni ed effettuare nuovamente l'invio.
◦ La consegna e il tempo di elaborazione dipendono dalla dimensione complessiva dell'invio, gli invii più grandi richiedono più tempo per essere consegnati ed elaborati.
◦ È necessario disporre di una firma elettronica per gli invii.
◦ I nomi dei file di invio possono includere solo un punto, utilizzato per indicare l'estensione del tipo di file, ad esempio 555.xml o 555.pdf.
2. Quando l'invio raggiunge l'ESG, è necessario ricevere la conferma n. 1 rapidamente dopo l'invio dell'eMDR, a meno che l'ESG sia inattivo a causa della manutenzione.
◦ In caso di ulteriori domande, contattare l'ESG all'indirizzo
esgreg@gnsi.com.
3. L'eMDR viene instradato automaticamente dall'ESG al Center for Devices and Radiological Health (CDRH). Quando l'invio raggiunge il CDRH, è necessario ricevere la conferma n. 2.
| Il sistema della FDA può impiegare 48 ore per l'invio della seconda conferma. Se non si riceve una risposta entro detti limiti di tempo, contattare l'ESG all'indirizzo esgreg@gnsi.com con il numero di report. Non inviare nuovamente l'eMDR fino a quando non viene visualizzato l'esito negativo in Windchill Customer Experience Management o finché non viene richiesto dalla FDA. Per istruzioni, vedere Risoluzione di un eMDR in ritardo. |
4. Quando il CDRH convalida e carica l'invio nel database Adverse Event (MAUDE), è necessario ricevere la conferma n. 3. Eventuali errori che si verificano durante la convalida e il caricamento vengono annotati.
| Se sono presenti messaggi di errore nella terza conferma, è necessario correggere gli errori ed effettuare nuovamente l'invio, partendo dal passo 1. Dopo il nuovo invio, si riceve un altro gruppo di tre conferme. Il sistema della FDA può impiegare 48 ore per l'invio della conferma n. 2 o n. 3. Se non si riceve una risposta entro detti limiti di tempo, inviare un'e-mail alla FDA all'indirizzo emdr@fda.hhs.gov con il numero di report. Attendere 24 ore tra quando si è contattato l'ESG e quando si è contattato la FDA. Non inviare nuovamente l'eMDR fino a quando l'invio non ha esito negativo o la FDA non lo richieda. Per istruzioni, vedere Risoluzione di un eMDR in ritardo. |