eMDR 프로세스 개요
FDA(미국 식품의약국)는 eMDR(Electronic Medical Device Reporting) 프로젝트를 시작했습니다. 이 프로젝트를 통해 제조업체, 임포터 및 사용자 시설은 전자 방식으로 의료기기 유해 이벤트 보고서를 제출할 수 있습니다.
eMDR은 전자 규제 제출을 수락하기 위한 기관 차원 솔루션인 ESG(Electronic Submissions Gateway)를 통해 제출됩니다. ESG는 단일 진입점을 사용하여 검토를 위해 규제 정보를 안전하게 제출할 수 있게 합니다.
|
|
사용자 Windchill Quality Solutions 설치에서 eMDR을 설정하려면 eMDR 시작하기를 참조하십시오. |
전자 제출 옵션
FDA는 다음 두 가지 전자 제출 옵션을 지원합니다.
• 높은 볼륨 일괄 처리 보고
◦ HL7(Health Level 7) ICSR(Individual Case Safety Report) 양식 제출
◦ B2B를 사용하여 FDA 게이트웨이를 통해 XML 파일 제출
• 낮은 볼륨 단일 보고
◦ 3500Z 양식 제출
◦ WebTrader를 사용하여 ESG를 통해 ZIP 파일 제출
eMDR 워크플로
Windchill Quality Solutions에서는 높은 볼륨 HL7(Health Level Seven) ICSR(Individual Case Safety Report) 양식의 온라인 버전을 작성했습니다. 양식을 작성하고 제출하면 Windchill Customer Experience Management에서 표준 XML을 사용하여 FDA용 3500A 형식으로 입력을 변환합니다. 그런 다음 Windchill Customer Experience Management에서 양식을 FDA로 전달합니다.
제출 프로세스 중 Windchill Customer Experience Management에서는 eMDR의 상태에 대해 ESG로부터 세 개의 별도 승인을 받습니다. Windchill Customer Experience Management에서는 들어오는 승인을 자동으로 처리하고 각 승인의 데이터를 각 eMDR에 대한 제출 테이블에 표시합니다. 세 개의 승인을 받는 동안 제출에 실패하면 문제가 있는 부분을 수정하고 다시 제출해야 합니다.
◦ 배달 및 처리 시간은 제출의 전체 크기에 따라 달라집니다. 제출이 클수록 배달 및 처리하는 데 더 오랜 시간이 걸립니다.
◦ 제출하려면 전자 서명이 있어야 합니다.
◦ 제출 파일 이름에는 파일 유형 확장자를 나타내는 데 사용되는 마침표 한 개만 포함될 수 있습니다(예: 555.xml 또는 555.pdf).
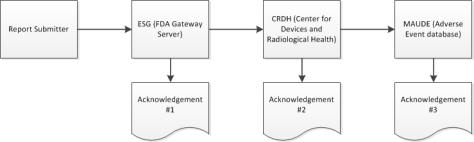
2. 제출이 ESG에 도달하면, ESG가 유지 관리를 위해 중단된 경우를 제외하고 eMDR 제출 후 즉시 승인 #1을 받게 됩니다.
3. eMDR은 ESG에서 CDRH(Center for Devices and Radiological Health)로 자동으로 라우팅됩니다. 제출이 CDRH에 도달하면 승인 #2를 받게 됩니다.
| FDA 시스템에서 두 번째 승인을 보내기까지 최대 48시간이 걸릴 수 있습니다. 이 시간 내에 응답을 받지 못한 경우 보고서 번호를 포함하여 ESG( esgreg@gnsi.com)로 문의하십시오. Windchill Customer Experience Management에서 제출이 실패한 것으로 표시되거나 FDA에서 별도의 지시가 있을 때까지 eMDR을 다시 제출하지 마십시오. 자세한 내용은 지연된 eMDR 해결을 참조하십시오. |
4. CDRH가 제출을 검증하고 유해 이벤트 데이터베이스(MAUDE)로 로드하면 승인 #3을 받게 됩니다. 검증 및 로드 중에 발생하는 모든 오류는 기록됩니다.
| 세 번째 승인에 오류 메시지가 있을 경우 프로세스를 처음부터 시작하여 오류를 수정하고 다시 제출해야 합니다. 다시 제출하면 세 가지 승인 세트를 다시 받게 됩니다. FDA 시스템에서 승인 #2 또는 #3을 보내기까지 최대 48시간이 걸릴 수 있습니다. 이 시간 내에 응답을 받지 못한 경우 보고서 번호를 포함하여 FDA( emdr@fda.hhs.gov)에 이메일을 보내십시오. ESG 문의 후 FDA 문의 전까지 24시간 동안 기다립니다. 제출이 실패하거나 FDA의 지시가 있을 때까지 eMDR을 다시 제출하지 마십시오. 자세한 내용은 지연된 eMDR 해결을 참조하십시오. |